
Patología del trasplante renal
Parte 1:
Generalidades, evaluación histológica del riñón
donante, rechazo (generalidades), rechazo hiperagudo, rechazo agudo acelerado,
rechazo agudo, clasificación de Banff
Parte 2: Rechazo crónico
y nefropatía crónica/esclerosante del injerto, toxicidad por ciclosporina
y tacrolimus, toxicidad por otros medicamentos
Parte 3: Infección por poliomavirus,
infección por citomegalovirus, otras
infecciones, neoplasias y enfermedades
glomerulares recurrentes y de novo
INFECCIÓN POR POLIOMAVIRUS (PV)
Se conocen al menos 13 especies de Poliomavirus, aunque parece que sólo cinco infectan humanos: virus BK (VBK) (Poliomavirus hominis tipo 1), virus JC (VJC) (Poliomavirus hominis tipo 2), Poliomavirus KI (Instituto Karolinska), Poliomavirus WU (Universidad de Washington) (estos últimos dos al parecer causarían infecciones respiratorias leves) y el Poliomavirus de células de Merkel asociado con carcinoma de células de Merkel. Los VBK y VJC se describieron inicialmente en 1971, aislados de dos pacientes con iniciales de su nombre: B.K. y J.C. respectivamente. Estos virus son miembros del grupo de los papovavirus, que incluye los Papilomavirus humanos. El VBK produce enfermedad principalmente en trasplantados renales y el VJC se ha asociado, en mayor medida, con leucoencefalopatía multifocal progresiva; ambos en pacientes inmunosuprimidos. El SV40 no se asocia con alguna enfermedad específica en humanos, pero, se ha descrito ADN viral en algunas neoplasias. La inmensa mayoría de casos de enfermedad renal son producidos por el VBK, en algunos pocos casos se encuentra VJC, pero usualmente asociados también a VBK, por lo que no parece que el VJC sea un patógeno muy relevante en trasplante renal. En este texto nos referiremos a la infección por el VBK.
Se cree que la infección se adquiere en la niñez a través de la vía respiratoria y también ha sido demostrada la transmisión vertical (transplacentaria) (Pietropaolo V, et al., Transplacental transmission of human polyomavirus BK. J Med Virol 56:372-6, 1998 [PubMed link]). Parece que los riñones son el principal sitio de latencia en el hombre, pero también puede encontrarse en sistema nervioso central y en sangre. Se dectan anticuerpos contra el virus en aproximadamente el 90% de personas a los 14 años de edad. En receptores de injertos renales se detectan anticuerpos contra el VBK entre el 55% y el 73% de los casos en el momento del trasplante. La reactivación ocurre cuando disminuye la inmunidad celular, pero otras alteraciones, como la isquemia del injerto, aparentemente juegan un papel importante en la reactivación. La demostración del PV en el tejido renal es necesaria para confirmar, con certeza, la nefritis intersticial (NI) asociada al PV. En los últimos años la nefropatía asociada al VBK ha sido reconocida como una importante causa de disfunción del injerto renal. Su incidencia es variable en diferentes centros, desde menos del 1% hasta casi el 10% de receptores de trasplante renal.
Es impoprtante definir tres términos
en relación con la infección por el virus:
Infección: Evidencia serológica o virológica
de que se ha tenido contacto con él y/o se ha desarrollado inmunidad.
Replicación: Evidencia de multiplicación
(infección activa o lítica): demostrar
células con cambio citopático en la orina ("decoy cells"),
encontrar mRNA de la proteina de replicación VP1 o demostrar DNA en orina o sangre.
Enfermedad: Evidencia de daño citopático
y afectación del órgano (demostrado por biopsia).
La replicación por reactivación inicial paraece que comienza en vías urinarias y el hallazgo más temprano es encontrar células con inclusiones en la orina, estas células se han conocido como "células trampa" o "células señuelo" ("decoy cells"), aquí las denominaremos por su apelativo en inglés debido s su uso generalizado. Este nombre lo utilizó inicialmente, desde los cincuenta, un histotecnólogo que trabajaba con el Profesor Leopold Koss: Andrew Ricci, quien llamaba así a células con cambios nucleares reactivos que hacían confundir con células malignas (de allí "células trampa"). En la primera edición del libro de citopatología del Dr. Koss, en 1968, antes de clasificarse el virus, ya él postulaba que muchas de estas alteraciones podrían deberse a una infección viral (Koss LG. Diagnostic Cytology and its Histopathologic Bases. 2º ed. Philadelphia, JB Lippincott, 1968). Actualmente la denominación "decoy cells" se utiliza exclusivamente para designar a las células con inclusiones características del PV en la orina. Es muy importante su detección porque 1.) aparecen antes de que se encuentre la enferemedad (nefritis intersticial); 2.) virtualmente todos los pacientes con nefritis intersticial asociada al virus (NIVBK) tienen abundantes decoy cells en orina: sensibilidad del 100%, aunque muchos pacientes sin la enfermedad también tienen replicación del virus en urotelio (hasta el 20%), por lo que la especificidad es muy baja (29%); es decir, su valor predictivo negativo es muy alto (casi 100%): si no hay decoy cells en orina, en tres días distintos, prácticamente descartamos la NIVBK.
Aunque la presencia de "decoy cells" en la orina tiene poca especificidad, el valor predictivo positivo de la citología urinaria se puede aumentar a más del 90% si se tienen en cuenta parámetros adicionales: (a) un fondo citológico "sucio", (b) presencia de "decoy cells" en el contexto de disfunción del injerto, (c) presencia de "decoy cells" persistiendo durante más de 6 semanas, y (d) la detección de cilindros de "decoy cells"(Singh HK, et al. Urine Cytology Findings of Polyomavirus Infections. In: Madame Curie Bioscience Database [Internet] [Link]).
Ver Caso 178 de nuestra serie de casos: cilindros celulares con "decoy cells" ("decoy cell casts").

Figura 22. "Decoy cells". Células en orina de un paciente trasplantado. Observe el aumento del tamaño nuclear, los cambios degenerativos del citoplasma, la inclusión homogénea intranuclear y la marginación de la cromatina a la periferia del núcleo, formando un anillo alrededor de la inclusión. Aspecto "típico" de las células "trampa" o "señuelo" ("decoy"). (Papanicolaou, X400).
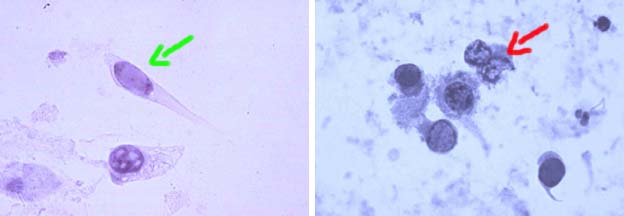
Figura 23. Otras características de las "decoy cells" son aspecto "en cometa" (izquiera, flecha verde) debido a alteraciones en el citoplasma; observe que hay una inclusión intranuclear. A la derecha vemos 6 células con inclusiones intranucleares ("decoy") y aspecto algo diverso en ellas. La flecha roja señala un par de células con cromatina granular, burda y núcleo roto; estas células han sido llamadas "estadio post-inclusión" y son, según el Dr. L. Koss, muy carcaterísticas de la infección por el PV. (Papanicolaou, X400).
Factores de riesgo: No hay un factor que en forma generalizada lleve a replicación y/o enfermedad, pero los que más se han asociado con ella son: tratamiento con tacrolimus o micofenolato mofetilo (MMF), concentraciones altas de tacrolimus (>8ng/mL), altas dosis de MMF, tratamiento con anticuerpos antilinfocíticos y con esteroides. De todas formas, aun en pacientes con iguales factores de riesgo, unos desarrollan la enfermedad y otros no, y en trasplantados de otros órganos como corazón e hígado, recibiendo dosis aun más altas de estos medicamentos, no suele desarrollarse la NIVBK, por lo que parece que hay factores determinantes del órgano (el riñón trasplantado).
Infección urotelial indica replicación del virus, pero no enfermedad. Desde los años setenta se ha dicho que el virus es causa de estenosis ureteral y de cistitis hemorrágica, sin embargo, nunca se ha demostrado su asociación causal. Recordemos que el virus puede reactivarse, con presencia de decoy cells, en hasta el 20% de trasplantados (Arias LF, et al. BK viral infection in kidney transplantation: importance of "decoy" cells. Acta Cytol 47: 1145, 2003 [PubMed link] Drachenberg CB, et al. Am J Transplant 4:2082-92, 2004 [PubMed link]), así que en pacientes con estenosis urotelial de cualquier causa podemos encontrar el virus, pero no como causa de la estenosis, sino como asociación casual. Nosotros hemos demostrado que la reactivación urotelial no se asocia con inflamación o alguna otra alteración subepitelial (Arias LF, et al. Nefrologia. 24:480-5, 2004. [PubMed link / Free full text]). Otros trabajos también hablan al respecto sobre esta falta de asociación "causal" entre el VBK y la estenosis ureteral y la cistitis hemorrágica (es posible que en trasplantados de médula ósea sea diferente) (Coleman DV et al. Br. Med J 3:371-5, 1973 [PubMed link]; Arthur RR, et al. N Engl J Med 315: 230-4, 1986 [PubMed link]; Cottler-Fox M, et al. Bone Marrow Transpl 4:279-82, 1989 [PubMed link]; Koss LG: Diagnostic Cytology, 4ª ed. 1992). Desde el punto de vista práctico, debemos buscar otras causas de estenosis ureteral y de cistitis hemorrágica y no atribuirlas al virus, al menos no en primera instancia.
La NIVBK se presenta de una manera muy inespecífica, hay elevación de la creatinina igual que en otras causas de nefropatía crónica/esclerosante del injerto, así que no hay ninguna característica clínica que sugiera esta enfermedad. En la mayoría de pacientes hay algún grado de proteinuria, usualmente leve, y otros hallazgos que indican daño túbulo-intersticial. La infección se detecta, en la mayoría de casos, en el primer año postrasplante, y es poco frecuente que se diagnostique la enfermedad después del 2° año del trasplante.
Histopatología
La nefritis intersticial sólo se confirma demostrando la replicación viral en el parénquima renal. Las inclusiones virales están presentes en las células de túbulos proximales y distales y en el epitelio urotelial. Las inclusiones son exclusivamente intranucleares y hay varios tipos morfológicos diferentes: 1.) núcleos claros con aspecto finamente granular y apariencia en “vidrio esmerilado”, con desplazamiento de la cromatina a la periferia del núcleo; 2.) una inclusión basófila o anfófila bien definida de material homogéneo (“inclusión sólida”); 3.) una inclusión eosinofílica central rodeada por un estrecho halo claro; 4.) una masa central irregular, rodeada por un espacio claro o vacío que la separa del anillo de cromatina periférica, algo parecidas a las inclusiones tipo Cowdry A; 5.) típicas inclusiones tipo Cowdry A. Estos tipos de inclusión no representan estadios diferentes de la enfermedad ni parecen tener relación con la severidad de la infección. Estos patrones de inclusión pueden presentarse en cualquier célula afectada, pero, las de tipo 3 y 4 se ven con más frecuencia en el urotelio. Las células infectadas contienen sólo un cuerpo de inclusión y están, a menudo, aumentadas de tamaño.

Figura 24. Podemos ver aquí dos patrones de inclusión intranuclear muy carcaterísticos de la infección por PV, diferentes a las de CMV y Herpesvirus. La de la izquierda ha sido descrita como "en vidrio esmerilado" y la de la derecha como "con aspecto gelatinoso". El la primera la inclusión está en una célula tubular y la segunda en la capa superficial del urotelio, sitio inicial de la reactivación viral en muchos (o la mayoría) de los casos. (H&E, X400).

Figura 25. Otros tres aspectos de inclusiones intranucleares del PV. Las de la izquierda y el centro, en nuestra experiencia, se suelen ver en el urotelio y muy pocas veces en túbulos renales; la de la derecha es una inclusión tipo Cowdry A y puede plantear mayor dificultad para distinguirla de CMV, sin embargo, en este último no se ven los otros patrones de inclusión, podemos encontrar inclusiones citoplasmáticas y hay citomegalia más prominente. (H&E, X400).
En los casos con infección tubular es frecuente encontrar células necróticas descamadas en su luz, denudación de la membrana basal, cilindros celulares y granulares, y grados variables de inflamación intersticial, con células plasmáticas y tubulitis. Las inclusiones en el urotelio se localizan predominantemente en las capas superficiales. En los especímenes de nefrectomía, las inclusiones se localizan principalmente en la corteza profunda y médula externa, con extensas áreas no comprometidas (Arias LF, et al. Virus BK en injertos renales: evidencia histológica de la infección. Nefrologia. 24:480-5, 2004. [PubMed link / Free full text]).

Figura 26. En esta biopsia renal por disfunción del injerto, en un paciente trasplantado 8 meses antes, podemos ver una inclusión intranuclear con aspecto "en vidrio esmerilado". Además, hay notorio infiltrado inflamatorio mononuclear y tubulitis en el mismo túbulo donde está la inclusión. Este hallazgo sugiere, en este caso particular, que la tubulitis no es debida a rechazo. (H&E, X400).
Para confirmar el tipo de virus es necesaria alguna técnica auxiliar, principalmnete inmunohistoquímica para VBK, o para SV40 que reacciona también con VBK y VJC; o podemos usar PCR específica para el virus.
En el diagnóstico diferencial debemos tener en cuentra otras infecciones virales. El citomegalovirus tiene inclusiones muy características y no presenta los patrones de inclusión descritos aqui para el VBK, además, suele presentar también inclusiones citoplasmáticas; si encontramos inclusiones en células endoteliales (frecuentes en CMV) es poco probable que se trate de VBK; en mi opinión, no es difícil diferenciar las inclusiones del VBK de las del CMV. También se describen como diagnóstico diferencial las inclusiones por Herpes virus y por adenovirus. Con el primero es frecuente ver inclusiones intranucleares tipo Cowdry A y multinucleación, y no suelen verse los patrones de inclusión del VBK. Con adenovirus puede ser más difícil y será necesaria inmunohistoquímica u otras pruebas moleculares (ver más adelante).
Un trabajo elaborado por un panel de expertos de todo el mundo propuso algunos aspectos claves en el diagnóstico, manejo e investigación de la NIVBK (Hirsch HH, et al. Transplantation 79; 1277-86; 2005 [PubMed link]):
1. Definir infección, replicación y enfermedad como lo vimos anteriormente
2. Definir: - Infección
Posible: presencia de decoy cells, mRNA de VP1 ó DNA en
orina
- Infección Presunta (o Probable): > ó
=10.000 copias de DNA del virus/mL en sangre o > ó =650.000 copias/ng
de RNA total en orina
- Diagnóstico Definitivo: Biopsia renal demostrando
la NI con las inclusiones del virus
3. Recomendar el screening en orina, busacando las "decoy cells", cada 3 meses los dos primeros años y luego cada año hasta los cinco post-trasplante (en la actualidad no todos los grupos o autores recomiendan screening en orina y prefieren PCR en sangre). La mayoría de casos de NIVBK se presenta en el primer año, unos pocos en el segundo y después del segundo año post-trasplante es muy inusual.
4. Utilizar técnicas para confirmar el diagnóstico virológico: Inmunohistoquímica (para SV40, o específico para BK), PCR para PV o para VBK y/o microscopía electrónica.
5. Hacer una valoración
semicuantitativa de la extensión de los cambios citopáticos: Aunque no podemos hablar de un método ideal, podría usarse la clasificación histopatológica sugerida por el grupo de trabajo de Banff publicada en 2017: La divide en 3 "clases": 1, 2 y 3, de acuerdo con la cantidad de túbulos con evidencia de replicación viral (por morfología o por inmunohistoquímica), designado con las letras "pvl" ("Poliomavirus load") y la extensión de la fibrosis intersticial (ci, ver Tabla 12)
- pvl 1: </= 1% de todos los túbulos o conductos con replicación viral
- pvl 2: >1% a </= 10% de todos los túbulos o conductos con replicación viral
- pvl 3: >10% de todos los túbulos con replicación viral
De acuerdo con la categoría de pvl y el porcentaje de fibrosis (ci) la Clasificación
histológicade la nefropatía por Poliomavirus (PVN) se haría así:
- PVN clase 1: pvl 1, ci</=1
- PVN clase 2: pvl 1, ci>/=2, o pvl 2 con cualquier ci, o pvl 3 con ci </= 1
- PVN clase 3: pvl3, ci >/=2
Nickeleit V, et al. The Banff Working Group Classification of Definitive Polyomavirus Nephropathy: Morphologic Definitions and Clinical Correlations. J Am Soc Nephrol. 2018;29(2):680-693 [PubMed link].
6. Si hay NIVBK además de hallazgos de rechazo podría ser que la inflamación intersticial y tubular sea debida a una respuesta a antígenos virales o al daño/necrosis epitelial, pero, también podría ser debida a rechazo. La sobreexpresión de HLA-DR tubular estaría a favor del rechazo, aun así es muy difícil el diagnóstico diferencial, por lo que la recomendación es: diagnosticar y manejar como ambos, dar tratamiento para rechazo agudo por unos días y luego manejar como NIVBK.
Importancia del estudio citológico
de orina:
1. Screening: Todos los casos con NIPV tienen abundantes
“decoy cells”. Orina persistentemente negativa descartaría
la enfermedad.
2. Seguimiento luego del diagnóstico. Si hay respuesta
al tratamiento habrá disminución de células infectada. Aún así, es importante hacer énfasis en que es mejor ayuda diagnóstica la PCR en sangre.
(Arias LF, et al. Virus BK en injertos renales: evidencia
histológica de la infección. Nefrologia. 24:480-5, 2004. [PubMed
link / Free
full text]; Drachenberg CB, et al. Hum Pathol 36:1245-55, 2005 [PubMed
link]; Arias LF, et al. BK viral infection in kidney transplantation:
importance of "decoy" cells. Acta Cytol 47: 1145, 2003 [PubMed
link])
Un aspecto llamativo en la infección por VBK es que puede causar depósito de complejos inmunes en la membrana basal tubular. Esta característica fue descrita en 43% de casos en una serie de Seattle y fue la causa más común de depósitos de IgG en las membranas basales tubulares de injertos renales (referencia 42 en: Colvin RB, Cornel LD. Current Diagnostic Pathology, 2007). En la inmunofluorescencia hay positividad focal, granular, para IgG, C3 y C4d y hay depósitos amorfos electron-densos en la microscopía electrónica. El significado pronóstico de estos hallazgos no se conoce. Estos depósitos no marcan para el antígeno T grande del VBK por técnicas de inmunohistoquímica (Colvin RB, Cornel LD. Current Diagnostic Pathology, 2007). Los depósitos pueden persistir después de que los antígenos virales se han hecho indetectables, por lo que podría ser que el BKV genere una respuesta autoinmune contra antígenos tubulares.
Ver Caso 12: Nefritis intersticial asociada a infección por Poliomavirus BK
INFECCIÓN POR CITOMEGALOVIRUS (CMV)
El CMV es el patógeno más importante en trasplantados debido a efectos directos e indirectos: mayor inmunosupresión y predisposición a otra infección (Pneumocistis, aspergilus, cándida, bacterias) y aumento del riesgo de rechazo. Suele producir infección en los primeros meses y se manifiesta con compromiso sistémico: fiebre, leucopenia, viremia, hepatitis, neumonitis y alteraciones de la función renal. El injerto puede verse afectado por infección directa o, indirectamente, por modificación o intensificación de la respuesta inmune con rechazo, probablemente en relación con sobreexpresión de HLA en células infectadas.
Adenovirus El compromiso del injerto renal por Adenovirus es poco frecuente y puede manifestarse como nefritis tubulointersticial necrotizante o como lesión ocupante de espacio. El diagnóstico diferencial incluye Poliomavirus y CMV cuando las inclusiones intranucleares están presentes. Sin embrago, la presencia de lesiones granulomatosas necrotizantes con infiltración neutrofílica debería considerarse característica de Adenovirus (Parasuraman R, et al. Severe necrotizing adenovirus tubulointerstitial nephritis in a kidney transplant recipient. Case Rep Transplant. 2013;2013:969186. [PubMed link]).

Figura 26a. Inflamación necrotizante en un caso de infección del injerto renal por Adenovirus. Se observan algunos núcleos grandes, con inclusiones virales. H&E, X200.

Figura 26b. El aspecto de necrosis coagulativa en algunos túbulos, con denso infiltrado inflamatorio mixto, a veces nodular, es muy sugerente de Adenoviruas en una biopsia de injerto renal. H&E, X400.
Ver Caso 112 de nuestra Serie de Casos: Infección por Adenovirus.
Ver Caso 152: Nefritis Intersticial Asociada a Adenovirus.
Los Herpesvirus 6 y 7 se han asociado con enfermedad sistémica: fiebre, hepatitis, mielosupresión, neumonitis intersticial, etcétera; y, al igual que con el CMV, se han relacionado con rechazo, principalmente en trasplante hepático. Los Herpesvirus tipo 1 y 2 también pueden producir infecciones cutáneas y de mucosas. El Herpesvirus 8 se relaciona con sarcoma de Kaposi y enfermedad de Castleman.

Figura 27. Célula grande, multinucleada, con inclusiones intranucleares. Es el aspecto carcaterístico del cambio citopático en infección por Herpesvirus de tipo 1 y 2. Esta biopsia fue tomada de una lesión ulcerada en el esófago de un paciente trasplantado renal 45 días. (H&E, X400).
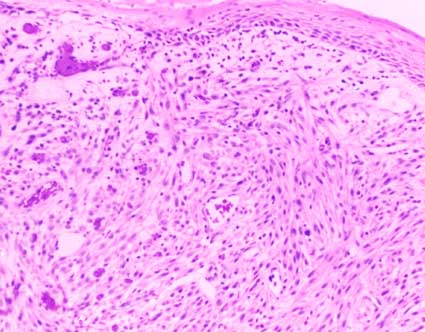
Figura 28. El sarcoma de Kaposi es una de las neoplasias más frecuentes en trasplantados renales, hay proliferación de células que forman pequeñas luces vasculares, se asocia a infección por Herpesvirus 8 y es potencialmente reversible con la disminución o suspensión de la inmunosupresión. (H&E, X300).
Virus Epstein-Barr: En inmunosuprimidos puede causar un síndrome similar a la mononucleosis; más rara es la presentación con meningitis, hepatitis o pancreatitis. Es el factor de riesgo más claramente definido para enfermedad linfoproliferativa post-trasplante, incrementando el riesgo en 10-76 veces. Con mucha frecuencia encontramos linfocitos periféricos, e intrarrenales (en el injerto) con virus latente (Ver un trabajo bastante interesante respecto al tema publicado por nuestro grupo: Arias LF et al, Epstein-Barr virus latency in kidney specimens from transplant recipients. Nephrol Dial Transplant 18:2638-43, 2003. [PubMed link / Free full text]).

Figura 29. Hibridación in situ en fragmento de un especímen de biopsia renal de un paciente con rechazo crónico. La mayoría de linfocitos son T, con linfocitos B dispersos, algunos de los cuales mostraron positividad para virus Epstein-Barr. (Hibridación in situ para EBER - demostrando latencia de virus Epstein-Barr, X400).
Otros virus que son patógenos en trasplante
renal incluyen: Varicela zozter, influenza,
virus respiratorio sincitial, Parvovirus
B19, virus papiloma y virus
linfotrópico humano, suelen producir afectación
extrarrenal y el compromiso del injerto no suele deberse a infección
directa del órgano. (Hay una buena revisión en:
Kotton CN, Fishman JA. Viral infection in the renal transplant
recipient. J Am Soc Nephrol 16:1758-74, 2005. [PubMed
link]).
ENFERMEDAD LINFOPROLIFERATIVA POST-TRASPLANTE (ELPT)
Es una proliferación linfoide, o linfoma, que se desarrolla como consecuencia de la inmunosupresión en un receptor de trasplante. La incidencia en la población de trasplantados es de aproximadamente 1-2% y se incrementa en pacientes que reciben dosis más agresivas de inmunosupresión. La enfermedad está, casi siempre, asociada a infección por virus Epstein-Barr. Puede ser policlonal o monoclonal. La presentación clínica será de acuerdo al órgano comprometido; si hay compromiso del injerto renal se prersenta con disfunción y, a veces, sensación de masa y/o hematuria. hay compromiso del injerto en aproximadamente el 25% de los casos. El compromiso extrarrenal puede ser nodal o extranodal (SNC, médula ósea, tracto gastrointestinal, hígado, pulmons, etcétera).
Histopatología
Si el compromiso es en el injerto podemos encontrar una masa bien definida que desplaza y comprime el tejido renal, pero es muy frecuente encontrar infiltración del parénquima por densoso acúmulos intersticiales que comprimen los túbulos, usualmente sin infiltrarlos (sin "tubulitis"). El aspecto de las células neoplásicas depende del tipo histológico, pero, en general, son células linfoides grandes, a veces plasmocitoides, con múltiples células apoptóticas. Solemos ver extensa distorsión de la arquitectura del órgano por el infiltrado.
En la gran mayoría de casos hay positividad para Epstein-Barr detectable por inmunohistoquímica o por hibridación in situ. Esta detección es importante en el diagnóstico diferencial: en la ELPT encontramos positividad para el virus en la gran mayoría de células, usualmente >80% y casi siempre >50%; en los infiltrados reactivos la positividad (es muy frecuente que la haya) es inferior al 10% en las células linfoides (Arias LF et al, Epstein-Barr virus latency in kidney specimens from transplant recipients. Nephrol Dial Transplant 18:2638-43, 2003. [PubMed link / Free full text])
La mayoría de casos son de fenotipo B, pero, alrededor de un 10% (o menos) son de fenotipo T, estos últimos menos asociados con Epstein-Barr.
En muchos pacientes con ELPT la(s) lesión(es) regresa(n) con la disminución o suspensión de los inmunosupresores. En algunos casos de verdadero linfoma el pronóstico es peor y las lesiones pueden seguir progresando a pesar de la suspensión de la inmunosupresión, siendo necesaria la quimioterapia.
| Tabla 14. Categorías enfermedad linfoproliferativa post-trasplante (ELPT) (Harris NL, et al. Post-transplant lymphoproliferative disorders. En Jaffe ES, et al, Pathology and Genetics of Tumours of Haematopoietic and Lymphoid Tissues. IARC Press, Lyon, 2001, pp. 264-271) |
| 1. Lesiones iniciales - Hiperplasia plasmocítica reactiva - Lesions similares a mononucleosis infecciosa |
| 2. ELPT polimórfica |
| 3. ELPT (clasificar de acuerdo a la clasificación
de linfomas) Neoplasias de células B - Linfoma difuso de células grandes de fenotipo B (inmunoblástico, centroblástico, anaplásico) - Linfoma de Burkitt / linfoma similar a Burkitt - Mieloma de células plasmáticas - Lesiones similares a plasmocitoma Neoplasias de células T - Linfoma periférico de células T, sin otra especificación (NOS) - Otros tipos |
| 4. linfoma de Hodgkin y ELPT similar a linfoma de Hodgkin |
En lesiones iniciales hay un infiltrado polimórfico con algún grado de preservación de la arquitectura; la hiperplasia plasmocítica se caracteriza por numerosas células plasmáticas con inmunoblastos de aspecto "raro", mientras las lesiones similares a mononucleosis la remedan en la expansión paracortical y numerosos inmunoblastos con un fondo de células T y plasmáticas. Estas lesiones se ven más en niños y en adultos sin infección previa por Epstein-Barr. Se encuentran principalmente en ganglios linfáticos.
La ELPT polimórfica (linfoma polimórfico de células B o hiperplasia polimórfica de células B) son lesiones destructivas de inmunoblastos, células plasmáticas y células linfoides de tamaño intermedio que borran la arquitectura de ganglios linfáticos o forman masas extrarrenales. A diferencia de la mayoría de linfomas, muestran todo el rango de maduración de células B, el aspecto es, a menudo, el de un linfoma mixto de células grandes y pequeñas. Puede haber muchas mitosis. Por inmunofenotipo hay mezcla de células B y T, pero la lesión es monoclonal en muchos de los casos. Estas lesiones pueden regresar, pero otras evolucionarán requiriendo tratamiento para linfoma.
La ELPT monomórfica son verdaderos linfomas y tienen morfología y características citológicas que permiten clasificarlos de acuerdo a la clasificación de linfomas en no trasplantados. Aunque pueden regresar con la suspensión de la inmunosupresión, en general, requieren quimioterapia.

Figura 30. ELPT monomórfica de células B. Hay densa infiltración por las células neoplásicas, con compresión de túbulos y glomérulos (estos últimos no mostrados en la imagen), sin tubulitis. La inmunohistoquímica mostró positividad difusa para CD20. Hibridación in situ para Epstein-Barr en la imagen siguiente. (H&E, X400).

Figura 31. Mismo caso que la figura 29. La hibridación in situ mostró positividad para EBER ("EBV-encoded small RNA", indica latencia del Epstein-Barr) en más del 85% de las células, un hallazgo que ayuda a confirmar el diagnóstico de ELPT. (Hibridación in situ para EBER, X400).
Ver el Caso 135 de nuestra Serie de Casos: PTLD polimórfico
OTRAS NEOPLASIAS POST-TRASPLANTE
El riesgo de malignidad incrementa con la inmunosupresión y, sobretodo, en algunos tipos de tumores: carcinoma espinocelular de piel, labio y cervix, sarcoma de Kaposi y enfermedad linfoproliferativa de células B, mientras que en muchos adenocarcinomas parece no haber un notorio incremento: mama, pulmón, próstata y colon. Muchos de los tumores que ocurren con más frecuencia están asociados a infección por virus papiloma, Epstein-Barr y herpesvirus 8. También hay aumento de tumores benignos como verrugas genitales y de la piel.
Sarcoma de Kaposi: Se presenta en hasta el 5,7% de trasplantados renales; está asociado con infección por el Herpesvirus 8. Es una proliferación de céluas vasculares fusiformes. El sitio más comprometido es la piel y orofaringe (60% en conjunto). La mayoría de casos remiten con la disminución o suspensión de los inmunuosupresores.
Sarcomas (alrededor del 1,7% de lesiones malignas en trasplantados): Los principales tipos son: sarcoma pleomórfico indiferenciado de alto grado, leiomiosarcoma, fibrosarcoma, rabdomiosarcoma, angiosarcoma y otros sarcomas indiferenciados.
ENFERMEDADES GLOMERULARES RECURRENTES Y DE NOVO
La recurrencia produce una pequeña pero significativa pérdida de injertos: 1-5%; en gemelos idénticos hay mayor tasa de recurrencia relacionada con la no inmunosupresión. El diagnóstico requiere, en muchos de los casos, la confirmación del diagnóstico pre-trasplante; en algunos casos la enfermedad original puede diagnosticarse (o al menos sospecharse) en biopsias del injerto.
La enfermedad de depósitos densos es la que más recurre, sin embargo, en muchos casos no produce disfunción ni pérdida del injerto, identificándose sólo los hallazgos morfológicos. Pueden encontrarse depósitos densos tan pronto como a la tercera semana post-trasplante. Curiosamente, hay depósitos densos antes que acumulación de C3 sugiriendo que el C3 no es uno de los principales factores patogénicos.
Otras de las enfermedades que más recurren son: nefropatía diabética, glomerulopatía fibrilar/inmunotactoide, nefropatía IgA, púrpura de Henoch-Schönlein, glomeruloesclerosis focal y segmentaria, síndrome hemolítico urémico, GN membranoproliferativa mediada por complejos inmunes, poliangeitis microscópica y GN membranosa (ver tabla 15).
| Tabla
15. Enfermedades glomerulares recurrentes (Modificado de Colvin RB. Renal Transplant pathology. En: Jennette JC, et al, Heptinstall's Pathology of the Kidney. 5º ed. Lippincott-Raven, Philadelphia, 1998, p. 1502) |
||
| Enfermedad
glomerular |
%
recurrencia |
%
pérdida injerto |
| Recurrencia usual - Enfermedad de depósitos densos - Glomerulopatía fibrilar inmunotactoide - Nefropatía diabética |
90 67 >50 |
15 0 >0 |
| Recurrencia común - Nefropatía IgA - Púrpura de Henoch-Schönlein - GE focal y segmentaria (primaria) - Síndrome hemolítico urémico - GN membranoproliferativa tipo I - Polinageitis microscópica - GN membranosa - Granulomatosis de Wegener - Síndrome nefrótico congénito (?) - Amiloidosis - GN extracapilar pauciinmune idiopática |
45 33 30 27 27 23 20 19 17 12 10 |
2 7 9 15 9 5 2 6 8 0 5 |
| Recurrencia inusual - Enfermedad anti-MBG - Nefritis lúpica |
3 4 |
3 1 |
| No se describe recurrencia - Síndrome hemolítico urémico diarrea+ - GN postinfecciosa - GE focal y segmentaria secundaria - Esclerosis glomerular focal familiar - Síndrome de Alport |
0 0 0 0 0 |
0 0 0 0 0 |
Del porcentaje total de casos de enfermedades recurrentes, la GEFyS es la más frecuente (aproximadamente 40% del total de glomerulopatías recurrentes); luego están la GNMP tipo I y enfermedad de depósitos densoso (15% en conjunto); la nefropatía IgA (15%) y la GN membranosa (10%). La GEFyS es, por lo tanto, la glomerulopatía que más impacto tiene en la supervivencia del injerto.
Las glomerulopatías recurrentes se presentan, en su gran mayoría, en los primeros meses post-trasplante, y las glomerulopatías de novo suelen hacerlo años después.
Nosotros hemos tenido la oportunidad de ver recurrencia de nefropatía IgA, amiloidosis y poliangeitis microscópica tan pronto como al mes del trasplante, aunque en los dos primeros casos, evidencia inmunopatológica y morfológica, respectivamente, sin enfermedad clínica.
Ver el Caso 127 de nuestra serie de casos (recurrencia de nefritis lúpica).
Enfermedades glomerulares de novo
Son enfermedades glomerulares que surgen en el injerto, sin historia previa de la glomerulopatía en el riñón nativo. Aunque en muchas la patogénesis, al igual que en las de riñón nativo, es deconocida, en algunas hay una respuesta aloinmune implicada: GN membranosa membranosa (asociada en muchos casos con anticuerpos anti-donante) y enfermedad anti-MBG en pacientes con enfermedad de Alport. Otra de las más frecuentes: Glomeruloesclerosis focal y segmentaria (GEFyS), se ha relacionado con alteraciones que producen hiperfiltración: secundaria.
La GN membranosa y la GEFyS se suelen desarrollar años después del trasplante: entre 2 y 10. La presentación clínica y los hallazgos morfológicos no difieren grandemente de la enfermedad en el riñón nativo.
También se han descrito otras glomerulopatías, pero, su frecuencia es baja.
Es muy importante en estos casos el estudio inmunopatológico para evitar confusión con lesiones glomerulares del trasplante.
Principales fuentes bibliográficas:
Bibliografía